Synteza i właściwości D-glikozaminozydów diosgenylu
Saponiny to zróżnicowana pod względem strukturalnym grupa glikozydów szeroko rozpowszechnionych w przyrodzie, głównie w królestwie roślin. Najczęściej spotykanymi saponinami naturalnymi są saponiny triterpenoidowe i steroidowe. Wśród glikozydów steroidowych wyróżnia się saponiny cholestanowe, furostanowe i spirostanowe. Należące do ostatniej klasy są szczególnie ważne z uwagi na szerokie spektrum właściwości biologicznych. Większość saponin została wyodrębniona z preparatów ziołowych stosowanych w medycynie ludowej, szczególnie w krajach Azji. W postaci ekstraktów ziołowych, maści, różnego rodzaju naparów są tam stosowane jako leki przeciw malarii, odtrutki przeciwko jadom węży i owadów oraz jako środki antyseptyczne, bakteriobójcze i przeciwwirusowe. Aglikon, czyli sapogeninę stanowi w nich m.in. diosgenina.
triterpenoidowe i steroidowe. Wśród glikozydów steroidowych wyróżnia się saponiny cholestanowe, furostanowe i spirostanowe. Należące do ostatniej klasy są szczególnie ważne z uwagi na szerokie spektrum właściwości biologicznych. Większość saponin została wyodrębniona z preparatów ziołowych stosowanych w medycynie ludowej, szczególnie w krajach Azji. W postaci ekstraktów ziołowych, maści, różnego rodzaju naparów są tam stosowane jako leki przeciw malarii, odtrutki przeciwko jadom węży i owadów oraz jako środki antyseptyczne, bakteriobójcze i przeciwwirusowe. Aglikon, czyli sapogeninę stanowi w nich m.in. diosgenina.
Fragment hydrofilowy saponin składa się zwykle z jednej lub kilku jednostek cukrowych. Najczęściej spotykanymi sacharydami wchodzącymi w ich skład są D-glukoza (D-Glc) i L-ramnoza (L-Rha).[[1]]
W naszym laboratorium uzyskaliśmy serię D-glikozaminozydów diosgenylu (Rys. 1) zawierających jako fragmenty cukrowe resztę D-glukozaminy lub D-galaktozaminy. Takie saponiny nie występują w naturze. Ich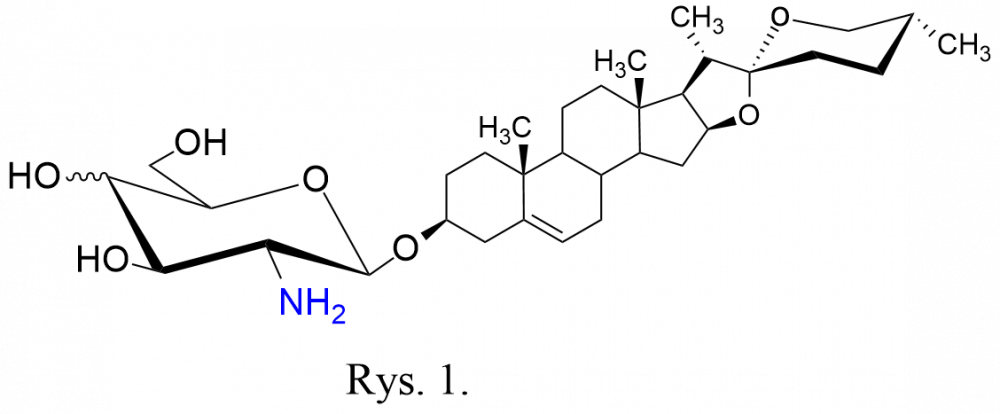 synteza polega na umiejętnym połączeniu chronionej D-glikozaminy – stanowiącej donor glikozylu – z akceptorem glikozylu, tj. diosgeniną. Do osłony grupy aminowej najczęściej stosowaliśmy osłonę tetrachloroftaloilową, a grupą odchodzącą przy anomerycznym atomie węgla był anion halogenowy.[[2],[3],[4],[5]] Po uzyskaniu glikozydu, następnym etapem było usunięcie osłon acetylowych i osłony z funkcji aminowej.
synteza polega na umiejętnym połączeniu chronionej D-glikozaminy – stanowiącej donor glikozylu – z akceptorem glikozylu, tj. diosgeniną. Do osłony grupy aminowej najczęściej stosowaliśmy osłonę tetrachloroftaloilową, a grupą odchodzącą przy anomerycznym atomie węgla był anion halogenowy.[[2],[3],[4],[5]] Po uzyskaniu glikozydu, następnym etapem było usunięcie osłon acetylowych i osłony z funkcji aminowej.
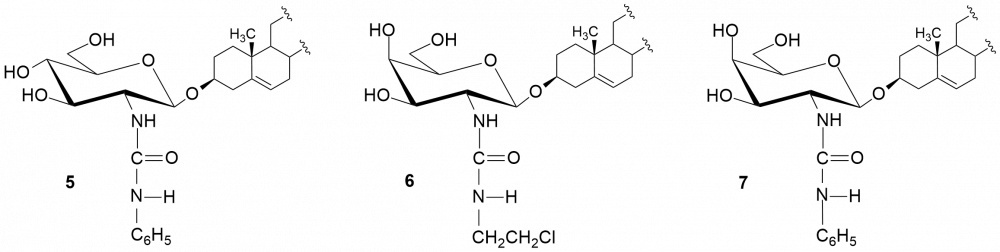
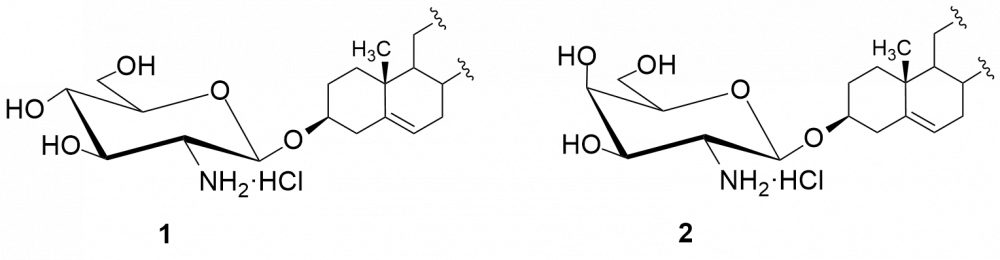
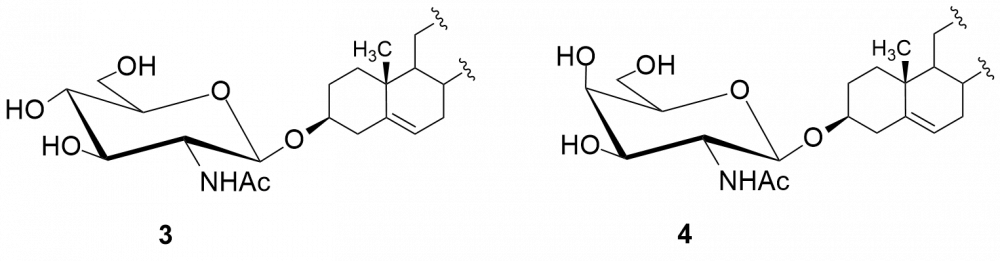
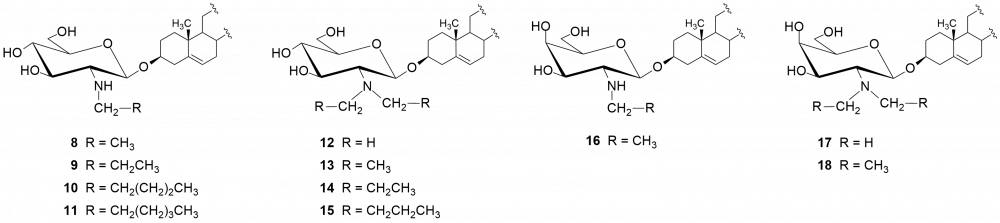
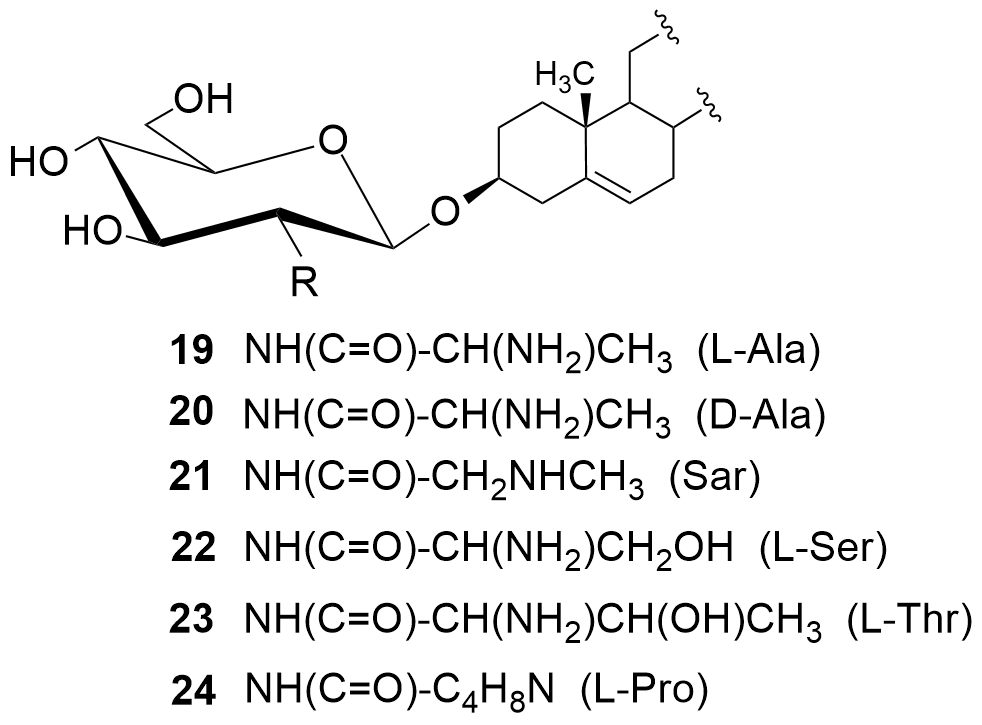
W kolejnych etapach dokonaliśmy funkcjonalizacji grupy aminowej. Otrzymaliśmy kilkadziesiąt pochodnych, m.in. chlorowodorki 1 i 2, pochodne acetylowe 3 i 4, z ugrupowaniem mocznikowym 5÷7, kilka N-alkilowych – saponiny 8÷11 i 16, N,N-dialkilowych – glikozydy 12÷15, 17 i 18 oraz kilkanaście N-acylowych pochodnych zwierających reszty aminokwasów, m.in. D- i L-alaniny, sarkozyny, L-seryny, L-treoniny czy L-proliny – saponiny 19÷24 (Rys. 2).
 |
 |
|
|
 |
 |
Rys. 2.
Chlorowodorki zostały otrzymane po sprotonowaniu grupy aminowej roztworem HCl w MeOH. Procedury modyfikacji funkcji aminowej polegały na jej acetylowaniu bezwodnikiem octowym, reakcji z komercyjnie dostępnymi izocyjanianami fenylu i 2-chloroetylu oraz redukcyjnym aminowaniu (reakcja z aldehydem i redukcja NaBH3CN). Natomiast do syntezy saponin z resztami aminokwasów wykorzystaliśmy klasyczną metodę syntezy w roztworze, polegającą na utworzeniu wiązania amidowego pomiędzy grupą karboksylową aminokwasu bądź hydroksykwasu a funkcją aminową w D-glukozaminozydzie diosgenylu.
Uzyskane saponiny zostały w różnym stopniu przebadane pod kątem ich aktywności przeciwnowotworowej i/lub przeciwdrobnoustrojowej (bakterie i grzyby).
W najszerszym zakresie został zbadany chlorowodorkek 2-amino-2-deoksy-β-D-glukopiranozydu diosgenylu (1). Badania przeciwnowotworowe chlorowodorku 1 i saponiny 5 polegały na określeniu ich wpływu na limfocyty wyizolowane z krwi pacjentów cierpiących na chłoniaka a leczonych 2-chlorodeoksyadenozyną (2-CDA, kladrybina). Obie saponiny wykazują cytotoksyczność wobec tych limfocytów.[2]
Kolejne badania in vitro i in vivo dla 1 przeprowadziliśmy na szczepach (referencyjnych i szpitalnych) bakterii Gram-dodatnich, ustalając minimalne stężenie hamujące w 50% i 90% (MIC50 i 90) oraz minimalne stężenie bakteriobójcze (MBC50 i 90). Badania prowadziliśmy dla szczepów metycylino- i wankomycyno-opornych (MR i VR) oraz metycylino- i wankomycyno-wrażliwych (MS i VS) gronkowca złocistego (Staphylococcus aureus) i paciorkowca kałowego (Enterococcus faecalis). Jako związki kontrolne stosowaliśmy ogólnodostępne antybiotyki, m.in. imipenem, doksycyklinę, erytromycynę, cyprofloksacynę. Wyniki badań dla saponiny 1 są porównywalne z rezultatami uzyskanymi dla wzorcowych antybiotyków. Zaobserwowaliśmy również, że stosowanie 1 z wankomycyną oraz daptomycyną prowadzi do uzyskania efektu synergistycznego wobec szczepów metycylino- i wankomycyno-wrażliwych (FIC w granicach 0,312÷0,458). Nie zaobserwowaliśmy efektu antagonistycznego.[[6]]
Biorąc pod uwagę rezultaty synergizmu przeprowadziliśmy badania in vivo na albinotycznym szczepie wsobnym myszy BALB/c. Jako antybiotyk referencyjny wybraliśmy wankomycynę. Największe bakteryjne zahamowanie uzyskaliśmy dla tkanki zakażonej gronkowcem lub paciorkowcem, która została potraktowana mieszaniną naszej saponiny i antybiotyku.[6]
Otrzymane saponiny badaliśmy również pod kątem zwalczania drobnoustrojów jakimi są grzyby. Tę aktywność badaliśmy na szczepach referencyjnych gatunków zaliczanych do drożdżaków Candida albicans i Candida tropicalis.[4,5] Wobec Candida najlepszą aktywność wykazała saponina 1 (MIC = 0,5 i 2 μg/ml, odpowiednio dla C. tropicalis i C. albicans). W następnej kolejności są trzy N,N-dialkilowe saponiny 12÷15 o krótkich łańcuchach węglowych (1÷3 atomów węgla) z MIC = 1÷4 μg/ml. Znacznie słabsze rezultaty otrzymaliśmy dla N,N-dialkilowych pochodnych o dłuższych łańcuchach węglowych (4÷6 atomów węgla), a saponiny N-monoalkilowe 8÷11 należy uznać za mało aktywne. Aktywność rzędu 4 μg/ml wobec C. albicans wykazywała także większość pochodnych zawierających reszty aminokwasowe – 19÷24.
Podobne testy wykonaliśmy dla D-galaktozaminozydów. Zmiana konfiguracji atomu węgla C-4 w pierścieniu cukrowym wpłynęła niekorzystnie na aktywność chlorowodorku 2 w porównaniu z jego odpowiednikiem D-gluko, hamuje on wzrost obydwu grzybów w mniejszym stopniu (dla C. tropicalis MIC = 4 µg/ml a dla C. albicans zaledwie 64 µg/ml). Jedynie wyniki dla N,N-dialkilowych pochodnych (dietylo i dipropylo) serii D-gluko 13 i 14 oraz serii D-galakto 17 i 18 są porównywalne (MIC ~ 4 μg/ml). Z kolei saponiny zawierające ugrupowania ureidowe (związki 6 i 7) należy uznać za nieaktywne.
Chlorowodorek D-gluko 1 oraz cztery N,N-dialkilowe pochodne o krótkich łańcuchach (12÷15) testowaliśmy dodatkowo na szpitalnych szczepach grzybów gatunku non-albicans Candida.[[7]] Rezultaty porównywaliśmy do wzorcowych środków przeciwgrzybiczych, m.in. amfoterycyny B, klotrimazolu, flukonazolu, itrakonazolu. Gatunek C. glabrata (odporny na flukonazol i itrakonazol) okazał się być podatnym na saponiny 1, 12 i 13, które hamowały wzrost grzyba w 90% przy stężeniu 4 μg/ml i niższym. Aż 4 saponiny (1 i 12÷14) wykazały silną aktywność wobec gatunku C. parapsilosis.
Do badań przeciwbakteryjnych użyliśmy po kilka szczepów referencyjnych bakterii Gram-ujemnych, m.in. Escherichia coli i Klebsiella pneumoniae oraz Gram-dodatnich, Enterococcus faecalis, Staphylococcus aureus i S. epidermidis.[4,5]
O ile wszystkie glikozydy okazały się nieaktywne w stosunku do bakterii G(–), to wobec bakterii G(+) większość N-alkilowych i N,N-dialkilowych saponin cechuje się dość różną aktywnością. Najaktywniejszymi okazały się pochodne N-etylowa (8) i N-propylowa (9), zarówno w serii D-gluko jak i D-galakto. Pochodne N,N-dialkilowe 12 i 13 wykazują słabszą aktywność od chlorowodorku 1 (MIC = 8÷16 μg/ml), a saponiny 14 i 15 lepszą.[4] O ile pochodne alkilowe serii D-galakto zachowywały się w podobny sposób do D-gluko, to nie można tego powiedzieć o chlorowodorkach obydwu serii.[5] Otóż, chlorowodorek 2 cechuje się brakiem aktywności wobec bakterii G(+). Wśród saponin serii D-galakto warto zwrócić uwagę na aktywność pochodnej 6, zawierającej przy atomie węgla C-2 fragment chloroetylomocznikowy (MIC = 2÷8 μg/ml).
Analizując wyniki aktywności pochodnych 19÷24, zawierających reszty aminokwasów, okazuje się że najwyższą aktywność wykazuje pochodna N-(D-alanylowa) (19), nieco słabszą N-sarkozylowa (21), N-(L-alanylowa) (20) i N-(L-prolilowa) (24), a jeszcze słabszą pochodne zawierające reszty L-hydroksyaminokwasów, tj. N-(L-serylowa) (22) i N-(L-treonylowa) (23).[[8]]
Dodatkowo dla saponin 1, 12÷15 i 19÷24 badaliśmy ich aktywność hemolityczną na ludzkich erytrocytach. Minimalne stężenie powodujące hemolizę (MHC) zostało ustalone jako najniższe stężenie, które powoduje przynajmniej 10±0,5% hemolizy. Wyniki badań hemolitycznych pokazały, że wymienione saponiny przy ich mikrobiologicznie aktywnych stężeniach są nietoksyczne dla ludzkich krwinek czerwonych.[7,8]
[1] H. Myszka, D. Bednarczyk, Wiad. Chem., 2005, 59, 275-303.
[2] H. Myszka, D. Bednarczyk, M. Najder, W. Kaca, Carbohydr. Res., 2003, 338, 133-141. https://doi.org/10.1016/S0008-6215(02)00407-X
[3] D. Bednarczyk, A. Walczewska, D. Grzywacz, A. Sikorski, B. Liberek, H. Myszka, Carbohydr. Res., 2013, 367, 10-17. http://dx.doi.org/10.1016/j.carres.2012.11.020
[4] A. Walczewska, D. Grzywacz, D. Bednarczyk, M. Dawgul, A. Nowacki, W. Kamysz, B. Liberek, H. Myszka, Beilstein J. Org. Chem., 2015, 11, 869-874. https://doi.org/10.3762/bjoc.11.97
[5] H. Myszka, P. Sokołowska, A. Cieślińska, A. Nowacki, M. Jaśkiewicz, W. Kamysz, B. Liberek, Beilstein J. Org. Chem., 2017, 13, 2310-2315. https://doi.org/10.3762%2Fbjoc.13.227
[6] O. Cirioni, H. Myszka, M. Dawgul, R. Ghiselli, F. Orlando, C. Silvestri, L. Brescini, W. Kamysz, M. Guerrieri, A. Giacometti, J. Med. Microbiol., 2011, 60, 1337-1343.
[7] M.A. Dawgul, D. Grzywacz, B. Liberek, W. Kamysz, H. Myszka, Med. Chem., 2018, 14, 460-467. https://doi.org/10.2174/1573406414666180226164747
[[8]] D. Grzywacz, M. Paduszyńska, M. Norkowska, W. Kamysz, H. Myszka, B. Liberek, Bioorg. Med. Chem., 2019, 27, 114923. https://doi.org/10.1016/j.bmc.2019.05.036
| Załącznik | Size |
|---|---|
| Diosgenina | 584.59 KB |