Zastosowanie reakcji Mitsunobu w syntezie O-amino pochodnych D-glikozaminozydów
Reakcja Mitsunobu jest znana od połowy lat sześćdziesiątych ub. wieku. Została odkryta przez Oyo Mitsunobu i wsp. w 1967 r. Wówczas została zaproponowana jako nowa metoda alkilowania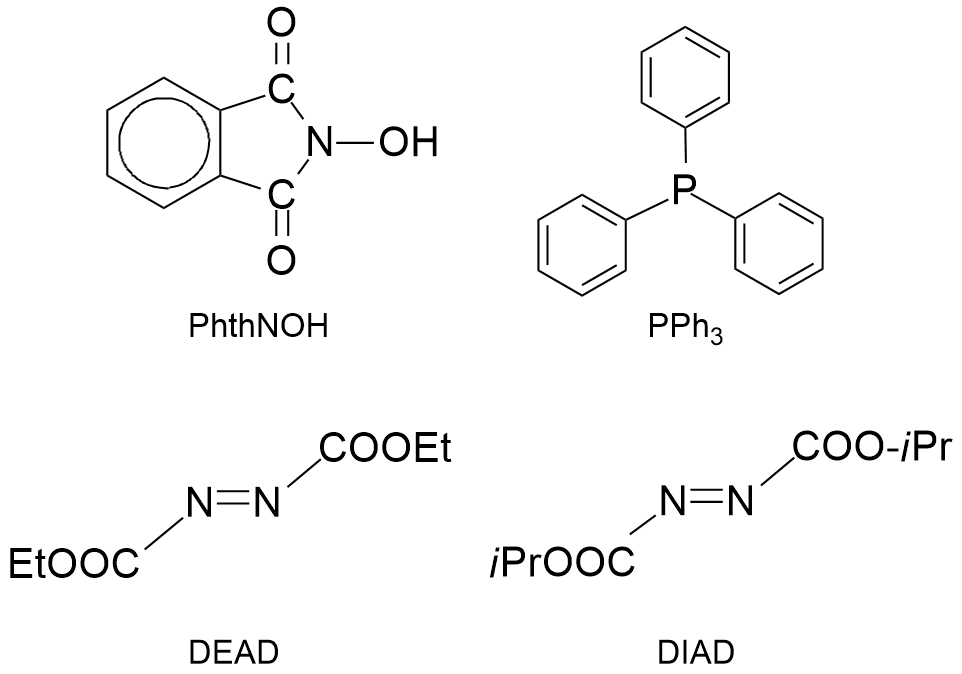 różnych grup związków organicznych. To reakcja chemiczna alkoholi z odpowiednim czynnikiem nukleofilowym, np. N-hydroksyftalimidem (PhthNOH) w obecności trifenylofosfiny (PPh3) i estru etylowego (DEAD) lub izopropylowego (DIAD) kwasu azodikarboksylowego.
różnych grup związków organicznych. To reakcja chemiczna alkoholi z odpowiednim czynnikiem nukleofilowym, np. N-hydroksyftalimidem (PhthNOH) w obecności trifenylofosfiny (PPh3) i estru etylowego (DEAD) lub izopropylowego (DIAD) kwasu azodikarboksylowego.
W zależności od użytego odczynnika nukleofilowe-go grupa hydroksylowa ulega przekształceniu w odpowiednią grupę funkcyjną, np. estrową czy O-aminową.
Reakcja Mitsunobu cechuje się całkowitą inwersją konfiguracji chiralnego alkoholu dla większości przypadków, co jest cenną właściwością w stereoselektywnej syntezie.
Projektowanie i synteza nowych cząsteczek o różnych funkcjach budzi ogromne zainteresowanie w chemii organicznej, bioorganicznej, medycznej i materiałowej. Możliwości syntezy funkcjonalizowanych związków ma duży wpływ na projektowanie cząsteczek bioaktywnych i odkrywanie nowych leków. Oprócz biologicznego zastosowania węglowodany są łatwo dostępnymi związkami chiralnymi szeroko stosowanymi w syntezie organicznej.
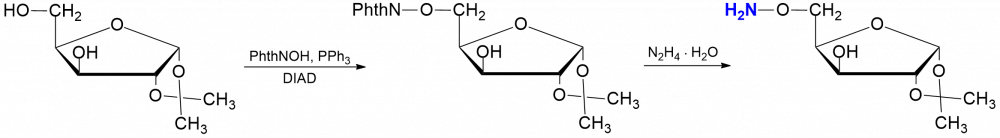
Wprowadzenie funkcji aminoksylowej w piranozydowych lub furanozydowych cukrowych stwarza możliwości uzyskania wielo-funkcyjnych bloków budulcowych, które mogą być wyko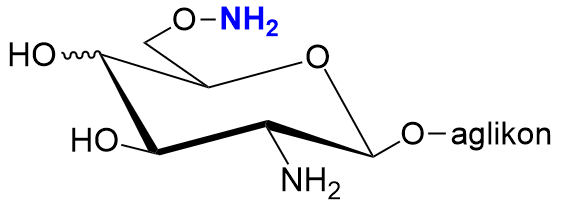 rzystane do syntezy nowych oligosacharydów lub glikokoniugatów o interesujących właściwościach strukturalnych.[1]
rzystane do syntezy nowych oligosacharydów lub glikokoniugatów o interesujących właściwościach strukturalnych.[1]
Mając to na uwadze planujemy syntezę 6-O-amino-D-glikozaminozydów, a więc nową rodzinę glikozaminozydów o nowych właściwościach przeciwdrobnoustrojowych i przeciwnowotworowych.
_________________
[1] N. Chen, J. Xie, Synthesis of O-Amino Sugars and Nucleotides. Molecules, 2018, 96, 641.




